Các kiểu hình phụ của ARDS: Hiểu biết về một hội chứng không đồng nhất
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
Các kiểu hình phụ của ARDS: Hiểu biết về một hội chứng không đồng nhất
Bài viết Các kiểu hình phụ của ARDS: Hiểu biết về một hội chứng không đồng nhất được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: ARDS Subphenotypes: Understanding a Heterogeneous Syndrome
Giới thiệu
Hội chứng suy hô hấp cấp (ARDS) là một hội chứng lâm sàng được xác định bởi tình trạng giảm oxy máu khởi phát cấp tính (PaO2:FiO2 ratio < 300) và hình mờ phổi hai bên không giải thích được đầy đủ do suy tim hoặc quá tải thể tích [1]. Định nghĩa đồng thuận của Berlin về ARDS, giống như định nghĩa Đồng thuận Mỹ-Âu trước đó, đã cho phép các bác sĩ lâm sàng và các nhà nghiên cứu như nhau xác định tiềm năng bệnh nhân mắc ARDS, thực hiện các chiến lược thông khí bảo vệ phổi và đưa bệnh nhân vào thử nghiệm lâm sàng. Tuy nhiên, ARDS vẫn chưa được công nhận về mặt lâm sàng; các liệu pháp điều trị còn hạn chế và tỷ lệ tử vong vẫn cao [2]. Việc không công nhận ARDS một phần có thể xuất phát từ sự không đồng nhất về mặt lâm sàng đáng kể được quan sát thấy giữa những bệnh nhân đáp ứng các tiêu chí ARDS tiêu chuẩn. Hội chứng có thể được khởi phát, ví dụ, do nhiễm trùng phổi hoặc ngoài phổi, hít sặc, chấn thương, truyền sản phẩm máu hoặc viêm tụy. Thâm nhiễm phổi có thể khu trú hoặc lan tỏa. Thiếu oxy máu có thể từ nhẹ đến nặng, và thời gian suy hô hấp có thể ngắn hoặc kéo dài. Nhiều biến thể lâm sàng trong số này có thể phản ánh sự khác biệt cơ bản về mặt sinh học giữa các bệnh nhân ARDS hiện được công nhận là động lực quan trọng của đáp ứng điều trị và kết quả cuối cùng.
Sự không đồng nhất đáng kể trong quần thể ARDS nói chung có khả năng góp phần vào sự thất bại của các liệu pháp thực nghiệm đối với ARDS trong các thử nghiệm lâm sàng lớn gần đây, mặc dù có dữ liệu tiền lâm sàng đầy hứa hẹn [3]. Xác định các kiểu hình phụ của ARDS – các nhóm đồng nhất hơn trong quần thể ARDS nói chung – là một cách tiếp cận để gỡ rối sự phức tạp về lâm sàng và sinh học mà nhiều người cho rằng là rào cản đối với việc khám phá ra các phương pháp điều trị mới thành công. Bằng cách xác định các nhóm kiểu hình phụ có ý nghĩa nhưng hiện chưa được công nhận bao gồm định nghĩa đồng thuận rộng rãi về ARDS, các biện pháp can thiệp có thể được kiểm tra hiệu quả hơn trong các nhóm được nhắm mục tiêu. Lựa chọn kiểu hình phụ của những bệnh nhân có nguy cơ cao hơn về kết quả xấu để tham gia thử nghiệm lâm sàng được gọi là làm giàu tiên lượng (prognostic enrichment) [4]. Việc lựa chọn những bệnh nhân có nhiều khả năng đáp ứng với một liệu pháp nhất định do cơ chế của lợi ích được gọi là làm giàu dự đoán (predictive enrichment) [4]. Cả hai chiến lược làm giàu đều được Cục Quản lý Thực phẩm và Dược phẩm khuyến nghị để tăng hiệu quả của các thử nghiệm lâm sàng trên tất cả các lĩnh vực, bằng cách tăng tỷ lệ kết cục quan tâm (outcome of interest) (làm giàu tiên lượng) hoặc bằng cách khuếch đại kích cỡ hiệu ứng (amplifying the effect size) (làm giàu tiên đoán). Những cách tiếp cận này có thể cho phép các nhà nghiên cứu phát hiện hiệu quả điều trị trong các nhóm nhỏ hơn, điều này đặc biệt quan trọng trong các hội chứng không đồng nhất như ARDS. Tuy nhiên, cuối cùng, việc phát hiện ra các kiểu hình phụ ARDS có thể làm phong phú hơn các quần thể thử nghiệm lâm sàng: trong vòng một thập kỷ tới, những đổi mới này có thể giúp chúng ta chuyển từ cách tiếp cận phù hợp với tất cả đối với điều trị ARDS sang các liệu pháp hiệu quả hơn, được điều chỉnh dựa trên hồ sơ lâm sàng và sinh học của từng bệnh nhân.
Chương này tóm tắt tình trạng khoa học về phân loại kiểu hình phụ của bệnh nhân ARDS, khám phá các đặc điểm sinh lý, lâm sàng và sinh học đã được tìm thấy để xác định các nhóm phụ đồng nhất hơn trong hội chứng không đồng nhất này (Bảng 1), và tác động tiềm năng của những tiến bộ này đối với việc thực hành bác sĩ lâm sàng trong đơn vị chăm sóc đặc biệt (ICU) và khoa cấp cứu.
Các kiểu hình phụ ARDS và làm giàu tiên lượng
Việc làm giàu tiên lượng trong nghiên cứu ARDS liên quan đến việc lựa chọn những bệnh nhân có khả năng mắc bệnh đặc biệt liên quan đến điểm cuối cao hơn, chẳng hạn như số ngày không thở máy ít hơn hoặc tỷ lệ tử vong cao hơn. Ngoài việc tăng hiệu quả nghiên cứu, việc xác định các kiểu hình phụ của bệnh nhân ARDS có nguy cơ cao nhất với kết cục kém cũng có thể dẫn đến cải thiện phân tầng nguy cơ tại giường bệnh, cho phép các bác sĩ lâm sàng lựa chọn những bệnh nhân có nhiều khả năng được hưởng lợi hơn từ việc chuyển viện giữa các cơ sở để có mức độ chăm sóc cao hơn hoặc xem xét sớm của các liệu pháp tích cực như oxy hóa qua màng ngoài cơ thể (ECMO).
| Bảng 1 Ví dụ về các yếu tố được sử dụng để xác định các kiểu hình phụ của hội chứng suy hô hấp cấp tính (ARDS) | ||
| Sinh lý | Lâm sàng | Sinh học |
| PaO2:FiO2 | Chấn thương với nội khoa | Bộ gen (Genomic) |
| Tỷ lệ khoảng chết | Trực tiếp với gián tiếp | Phiên mã (Transcriptomic) |
| Áp lực đẩy | Khu trú với lan tỏa | Hệ protein (Proteomic) |
| ± Tổn thương thận cấp | Chuyển hóa (Metabolomic) | |
Kiểu hình sinh lý để làm giàu tiên lượng
Phân tầng nguy cơ của bệnh nhân ARDS không phải là một chiến lược mới. Bản thân định nghĩa Berlin phân loại ARDS thành ba phân nhóm (Bảng 2) theo mức độ giảm oxy máu (nhẹ, trung bình và nặng), và tử vong tăng lên khi tỷ lệ PaO2: FiO2 giảm [1]. Ưu điểm của phương pháp này là tỷ lệ PaO2:FiO2 có sẵn ở tất cả bệnh nhân ARDS và không yêu cầu giải thích của chuyên gia hoặc đánh giá lâm sàng chủ quan. Nhiều thử nghiệm ARDS lâm sàng lớn đã sử dụng tỷ lệ PaO2:FiO2 để làm giàu tiên lượng. Ví dụ, thử nghiệm ACURASYS về phong tỏa thần kinh cơ liên tục sớm [5], thử nghiệm PROSEVA về vị trí nằm sấp [6] và thử nghiệm ROSE đánh giá lại việc phong tỏa thần kinh cơ liên tục sớm [7] tất cả các bệnh nhân mục tiêu bị ARDS từ trung bình đến nặng (Tỷ lệ PaO2:FiO2 < 150 mmHg). Cả ba thử nghiệm này đều có tiêu chí tử vong và cả ba thử nghiệm đều có tỷ lệ tử vong ở nhóm đối chứng vượt quá 40%.
| Bảng 2 Định nghĩa của Berlin về ARDS phân loại bệnh nhân theo mức độ nghiêm trọng của tình trạng thiếu oxy của họ; mức độ nghiêm trọng ngày càng tăng có liên quan đến tăng tỷ lệ tử vong [1] | |||
| Độ nặng | Tỷ lệ PaO2:FiO2 (mmHg) | Bệnh nhân(%) | Tỷ lệ tử vong (%) |
| Nhẹ | 201-300 | 22 | 27 |
| Trung Bình | 101-200 | 50 | 32 |
| Nặng | ≤100 | 28 | 45 |
Ngoài tỷ lệ PaO2:FiO2, một số biến số sinh lý khác được biết đến để dự đoán kết cục xấu trong ARDS. Tỷ lệ khoảng chết [8], tỷ lệ thông khí (chỉ số thông khí kém tại giường đơn giản) [9], và áp lực đẩy (đo lường mức độ độ giãn nở của hệ thống hô hấp) đều có liên quan độc lập với kết cục kém trong ARDS [10] và các phép đo thường quy hơn những biến số này có thể cải thiện sự phong phú về tiên lượng trong các thử nghiệm lâm sàng và dự đoán rủi ro trong thực hành lâm sàng.
Tuy nhiên, một hạn chế của việc sử dụng các phép đo sinh lý này là các biến số này có thể thay đổi nhanh chóng. Ví dụ, việc áp dụng áp lực dương cuối thì thở ra (PEEP) cao hơn có thể nhanh chóng chuyển bệnh nhân từ phân nhóm mức độ trầm trọng của ARDS sang phân nhóm khác, hoặc bệnh nhân hút đàm tại thời điểm đặt nội khí quản bị giảm oxy máu nặng, có thể cải thiện trong vòng vài giờ. Có lẽ về cơ bản hơn, các đặc điểm sinh lý chung trong hầu hết các trường hợp không thể hiện được sự khác biệt quan trọng về sinh học giữa các bệnh nhân ARDS. Một bệnh nhân mắc ARDS liên quan đến truyền máu có thể có cùng tỷ lệ PaO2:FiO2 hoặc áp lực đẩy như một bệnh nhân mắc ARDS do cúm H1N1, nhưng sinh lý bệnh cơ bản của họ có thể rất khác và họ không có cùng nguy cơ dẫn đến kết cục kém. Thật vậy, định nghĩa của Berlin về ARDS còn lâu mới hoàn hảo như một công cụ dự báo tử vong, với diện tích dưới đường cong chỉ là 0,577 [1].
Kiểu hình lâm sàng để làm giàu tiên lượng
Nhận ra những hạn chế của phương pháp tiếp cận sinh lý học thuần túy đối với bệnh nhân kiểu hình phụ ARDS, các nhà điều tra cũng đã kiểm tra các biến số lâm sàng khác nhau để tăng cường sự phong phú về tiên lượng (Bảng 1). Ví dụ, bệnh nhân ARDS sau chấn thương được phát hiện có nguy cơ tử vong thấp hơn so với bệnh nhân ARDS không do chấn thương (tỷ số chênh 0,44) [11]. Luo và cộng sự phát hiện ra rằng mặc dù tỷ lệ tử vong nói chung tương tự nhau, các yếu tố dự báo tử vong khác nhau giữa ARDS trực tiếp (kích hoạt tại phổi) và gián tiếp (kích hoạt ngoài phổi) [12]. Bệnh nhân ARDS bị chấn thương thận cấp tính (AKI) đã được chứng minh là có tỷ lệ tử vong cao hơn đáng kể so với bệnh nhân không có AKI trong một số nhóm thuần tập [13, 14]. Do đó, khi cố gắng xác định bệnh nhân ARDS nguy cơ cao, bệnh nhân không do chấn thương và bệnh nhân có AKI đáng kể là một nhóm phụ có nguy cơ cao hơn, nhưng các yếu tố dự báo tử vong khác nhau tùy thuộc vào tổn thương phổi là trực tiếp hay gián tiếp.
Ngoài các đặc điểm lâm sàng cơ bản, thời gian điều trị ARDS là một yếu tố khác có thể xác định những bệnh nhân có nguy cơ bị kết cục kém hơn. Cả thời gian khởi phát và thời gian mắc bệnh đều có giá trị tiên lượng. Một số nghiên cứu đã chỉ ra rằng ARDS khởi phát > 48 giờ sau khi nhập viện ICU có liên quan đến tỷ lệ tử vong cao hơn [15, 16]. Không ngạc nhiên khi ARDS cải thiện nhanh chóng (ARDS tự khỏi trong vòng 1 ngày) có tiên lượng tốt hơn ARDS dai dẳng. Tuy nhiên, điều thú vị hơn là phát hiện hầu hết (63%) bệnh nhân ARDS cải thiện nhanh có biểu hiện giảm oxy máu vừa hoặc nặng [17], làm nổi bật những hạn chế của việc chỉ sử dụng tỷ lệ PaO2:FiO2 để xác định bệnh nhân tham gia thử nghiệm lâm sàng. Nhận thức được vấn đề này, thử nghiệm PROSEVA về định vị nằm sấp chỉ ghi nhận bệnh nhân nếu họ tiếp tục đáp ứng các tiêu chuẩn thu nhận (tỷ lệ PaO2:FiO2 < 150 mmHg) sau 12–24 giờ ổn định [7].
Hình ảnh X quang của thâm nhiễm phổi cũng được sử dụng để phân loại bệnh nhân ARDS thành các phân nhóm đồng nhất hơn và xác định những người có nguy cơ tử vong cao nhất, đơn độc hoặc kết hợp với các biến số sinh lý và lâm sàng khác. Một nghiên cứu tiền cứu nhỏ cho thấy bệnh nhân ARDS có thâm nhiễm không khu trú có tỷ lệ tử vong cao hơn so với bệnh nhân có tổn thương trên X quang khu trú [18]. Thử nghiệm CESAR của ECMO đối với ARDS nặng yêu cầu Điểm phổi Murray (kết hợp chụp X quang phổi)>3 để đủ tiêu chuẩn (hoặc pH <7,20) [19, 20]. Gần đây hơn, điểm RALE – được phát triển để định lượng một cách có hệ thống mức độ và mật độ thâm nhiễm phế nang trên phim X quang ngực – đã được chứng minh để dự đoán tử vong trong 28 ngày với diện tích dưới đường cong là 0,82 [21].
Tuy nhiên, một nhược điểm rõ ràng là chỉ dựa vào các đặc điểm lâm sàng để xác định kiểu hình là khả năng phân loại sai. Trong một thử nghiệm gần đây về thông khí cơ học được cá nhân hóa theo sự hiện diện của thâm nhiễm khu trú và lan tỏa trong ARDS (sẽ thảo luận thêm ở phần sau), 21% các kiểu hình phụ X quang được chỉ định tại thời điểm ngẫu nhiên đã bị phân loại sai [22]. Tương tự, các nhà điều tra gặp khó khăn trong việc phân loại bệnh nhân là mắc ARDS trực tiếp hay gián tiếp, với 37% trường hợp được coi là không thể phân loại được trong một thử nghiệm [23]. Cần có những cách tiếp cận thực dụng và đáng tin cậy để phân loại để vượt qua những thách thức vốn có đối với việc phân loại kiểu hình lâm sàng.
Kiểu hình sinh học để làm giàu tiên lượng
Tiếp theo là ngày càng có nhiều sự quan tâm trong việc xác định các kiểu hình phụ sinh học của bệnh nhân ARDS. Các dấu hiệu sinh học được coi là gần với biểu hiện lâm sàng của ARDS, và có khả năng ít gặp các vấn đề về phân loại sai khiến việc xác định kiểu hình lâm sàng trở nên khó khăn. Hơn nữa, hiểu biết của chúng tôi về sinh học ARDS đã tiến bộ rất nhiều trong thập kỷ qua. Bây giờ chúng ta hiểu rõ hơn về cách một tổn thương ban đầu gây ra một đợt viêm dẫn đến tổn thương thêm cho phế nang và vi mạch của nó (Hình 1) [3].
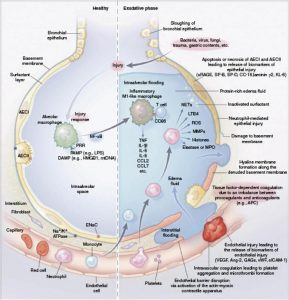
”AECI: tế bào biểu mô phế nang loại I, AECII: tế bào biểu mô phế nang loại II, Ang- 2: angiopoietin-2, APC: protein hoạt hóa C, CC-16: tế bào club (trước đây là tế bào Clara) tiết protein 16, CCL: phối tử chemokine (CC motif), DAMP: mô hình phân tử liên kết tổn thương, EnaC: kênh natri biểu mô, GAG: glycosaminoglycan, HMGB1: protein nhóm 1 có tính di động cao, KL-6: Krebs von den Lungen 6, LPS: lipopolysaccharide, LTB4: leukotriene B4, MMP: ma trận metalloproteinase, MPO: myeloperoxidase, mtDNA: ty thể DNA, Na+/K+ ATPase: Bơm natri-kali ATPase, NF-κB: yếu tố hạt nhân chất tăng cường chuỗi ánh sáng kappa của tế bào B hoạt hóa, NET: bẫy ngoại bào trung tính, PAMP: mẫu phân tử liên quan đến mầm bệnh, PRR: thụ thể nhận dạng mẫu, ROS: loại oxy phản ứng, sICAM: kết dính gian bào hòa tan phân tử, SP: protein hoạt động bề mặt, sRAGE: thụ thể hòa tan cho các sản phẩm cuối quá trình glycation tiên tiến, TNF: yếu tố hoại tử khối u, VEGF: yếu tố tăng trưởng nội mô mạch máu, vWF: yếu tố von Willebrand. (Được sử dụng lại từ [3] với sự cho phép)”
Đo các dấu ấn sinh học huyết tương trong ARDS có thể giúp tìm ra các phân nhóm bệnh nhân có chung các đặc điểm đáp ứng vật chủ quan trọng và/hoặc có kết quả lâm sàng xấu hơn. Nhiều yếu tố gen, phiên mã, hệ protein và chuyển hóa đã được nghiên cứu cho mục đích này, với độ sâu nghiên cứu lớn nhất tập trung vào các dấu ấn sinh học protein huyết tương của ARDS. Chúng bao gồm các dấu hiệu của viêm hệ thống (interleukin [IL]-6, IL-8, yếu tố hoại tử khối u hòa tan [TNF] thụ thể-1, IL-18), tổn thương biểu mô (angiopoietin-2, phân tử kết dính gian bào-1), tổn thương nội mô (thụ thể hòa tan cho các sản phẩm cuối glycation nâng cao [sRAGE], protein hoạt động bề mặt-D), và đông máu bị rối loạn (chất ức chế hoạt hóa plasminogen-1, protein C), tất cả đều được chứng minh là có giá trị tiên lượng [24]. Ví dụ, mức cơ bản của sRAGE, đã dự đoán độc lập tỷ lệ tử vong trong 90 ngày trong một phân tích tổng hợp [25]. Gần đây hơn, Rogers và cộng sự phát hiện ra rằng tăng nồng độ IL-18 huyết tương ban đầu và tăng nồng độ IL-18 đều có liên quan đến tăng tỷ lệ tử vong trong ARDS do nhiễm trùng huyết [26].
Sử dụng phương pháp tiếp cận để xác định các phân nhóm trong một quần thể không đồng nhất được gọi là phân tích lớp tiềm ẩn (LCA, latent class analysis), hai kiểu hình phụ khác biệt của ARDS được xác định dựa trên dữ liệu lâm sàng và sinh học kết hợp từ những bệnh nhân tham gia vào hai nhóm thử nghiệm lâm sàng lớn [27]. Kiểu hình phụ “tăng viêm” (hyper- inflammatory) được đặc trưng bởi tình trạng viêm tăng cường, số ngày không có máy thở ít hơn và tăng tỷ lệ tử vong so với kiểu hình phụ “giảm viêm” (hypo-inflammatory) (Hình 2). Hai kiểu hình phụ này đã được tìm thấy trong các phân tích độc lập tiếp theo của nhiều nhóm thử nghiệm ARDS khác, và tiên lượng xấu liên quan đến kiểu hình tăng viêm vẫn tồn tại [28, 29]. Sử dụng một cách tiếp cận khác, được gọi là phân cụm phân cấp, để phân tích một bảng các dấu ấn sinh học huyết tương từ bệnh nhân ARDS, Bos và cộng sự đã xác định được hai kiểu hình phụ tương tự: kiểu hình phụ “phản ứng” (reactive) đặc trưng bởi tình trạng viêm nhiều hơn và tăng tỷ lệ tử vong và kiểu hình phụ “không bị viêm” (uninflamed) liên quan đến kết quả tốt hơn [30]. Tổng hợp lại, những phát hiện này ủng hộ ý tưởng rằng bệnh nhân ARDS có thể được phân tầng theo các dấu hiệu viêm để làm giàu tiên lượng.
![Hình 2. Các kiểu hình phụ giảm viêm và tăng viêm của ARDS có liên quan đến các dấu ấn sinh học và kết quả khác nhau. Hai kiểu hình phụ khác biệt này đã được xác định bởi Calfee và cộng sự trong nhiều nhóm thử nghiệm lâm sàng ARDS trước đó [27, 29, 40, 41].](https://www.healcentral.org/wp-content/uploads/2020/08/cac_kieu_hinh_phu_cua_ards_hieu_biet_ve_mot_hoi_chung_khong_dong_nhat_2-300x175.jpg)
Thật vậy, việc đo lường các dấu ấn sinh học protein và dữ liệu “-omics” ở bệnh nhân ARDS hiện không có sẵn bên ngoài môi trường nghiên cứu. Hơn nữa, tác động của việc xác định kiểu hình phụ sinh học đối với kết cục cuối dòng (downstream) ở bệnh nhân ARDS chưa được đánh giá tiền cứu. Các nhà điều tra gần đây đã xác định được một mô hình “phân biệt đối xử” phân loại bệnh nhân ARDS là “giảm” hoặc “tăng viêm” chỉ sử dụng ba dấu ấn sinh học huyết tương (IL-8, bicarbonate và protein C) [34], và phân tích nhanh các dấu ấn sinh học để xác định kiểu hình phụ ARDS tại điểm chăm sóc hiện đang được thí điểm. Phát triển các xét nghiệm nhanh là một bước quan trọng trong việc tận dụng việc xác định các kiểu hình phụ ARDS để làm giàu tiên lượng trong các thử nghiệm lâm sàng trong tương lai, và cuối cùng đưa những khám phá này vào đầu giường.
Kiểu hình phụ ARDS và làm giàu dự đoán
Song song với các chiến lược khác nhau này để xác định các phân nhóm và kiểu hình để làm giàu tiên lượng trong ARDS, các nhà điều tra cũng đã nghiên cứu các hiệu quả điều trị thay đổi như thế nào theo kiểu hình phụ. Bằng cách tìm ra phản ứng điều trị theo kiểu hình phụ cụ thể một cách hồi cứu hoặc điều trị nhắm mục tiêu dựa trên cơ chế và đặc điểm sinh học, các nhà nghiên cứu sau đó có thể tiếp tục thử nghiệm tiền cứu các can thiệp mới ở những bệnh nhân có nhiều khả năng đáp ứng hơn. Cách tiếp cận này cung cấp khả năng dự đoán phong phú hơn: bằng cách khuếch đại đáp ứng điều trị, khả năng phát hiện lợi ích từ các liệu pháp thử nghiệm tăng lên và việc khám phá trở nên hiệu quả hơn. Cũng giống như kiểu hình sinh học của các bệnh khác, chẳng hạn như ung thư vú hoặc hen suyễn, đã dẫn đến những cải thiện quan trọng trong kết quả của bệnh nhân, mục tiêu cuối cùng là triển khai các liệu pháp nhắm mục tiêu cho ARDS theo đặc điểm của bệnh nhân, chuyển lĩnh vực này từ chăm sóc theo phác đồ sang y học chính xác.
Kiểu hình sinh lý để làm giàu dự đoán
Trong khi nhiều người xem các thông số sinh lý học như tỷ lệ PaO2:FiO2 là các chỉ số tiên lượng thuần túy, chúng cũng có thể cung cấp khả năng dự đoán phong phú hơn. Như Prescott và cộng sự. lưu ý trong cuộc thảo luận của họ về các chiến lược thử nghiệm lâm sàng ARDS, tỷ lệ PaO2:FiO2 thấp hơn không chỉ xác định những bệnh nhân có nguy cơ tử vong cao hơn mà còn phản ánh những bệnh nhân có trọng lượng phổi lớn hơn, những người có nhiều khả năng được hưởng lợi hơn từ các cuộc điều động tuyển dụng, PEEP cao hơn hoặc nằm nghiêng [35]. Tương tự, người ta có thể đưa ra giả thuyết rằng trong số những bệnh nhân bị ARDS nặng, những người có áp lực bình nguyên > 30 cmH2O hoặc áp lực đẩy không thuận lợi mặc dù tuân thủ chiến lược thông khí bảo vệ phổi có thể có nhiều khả năng được hưởng lợi hơn từ việc “phổi nghỉ ngơi” với mức cực thấp thể tích khí lưu thông trên ECMO.
